エアロゾル再考
はじめに
2020年初頭に始まった新型コロナウイルス感染症の流行は、人々が国境を簡単に移動し、世界中が経済的・社会的・文化的に密接につながった21世紀の世界に大きな変化をもたらしている。新型コロナウイルスは主に飛沫感染によって伝播すると考えられているが、感染者とともに長時間換気の悪い空間にいるなどの限定的な状況では空気感染が起こりうる可能性が指摘されている[1]。
関連して、普段世間の話題に上ることのない「エアロゾル」や「空気感染」といった言葉がメディアに登場する機会も増えており、感染症専門家でなくても医師やその他の医療関係者であれば、同僚や一般の方からエアロゾルや空気感染について質問されることが多くなっているのではないだろうか。
本稿では、新型コロナウイルス感染症について理解する上で重要な、意外とよく知られていないエアロゾルと空気感染の基本事項についてまとめてみた。
通念上の飛沫感染と空気感染の話
飛沫感染とは、病原体を含む気道由来の飛沫が感染者から被感染者へと直接的に伝播する感染様式のことである[2]。感冒を起こすウイルスの大半や髄膜炎菌、A群溶血性連鎖球菌などがこのカテゴリーに分類され、0.9m(3フィート)以上の距離を保つ、カーテンで飛沫を遮断する、サージカルマスクを着用する、などの対策がとられる。
一方、空気感染とは、病原体を含む小粒子が感染性を維持したまま長期間空気中に拡散しているのを被感染者が吸い込むことで伝播する感染様式のことで、元の感染者と対面していなくても成立する点が飛沫感染と大きく異なる。CDCのガイドラインでは、空気感染対策が必要と明言されている病原体は、麻疹ウイルス、水痘・帯状疱疹ウイルス、結核菌の3種類で、SARSコロナウイルス(SARS-CoV)については必要な可能性があるとの記載にとどまっている[2]。これらの病原体が関与しうる場合は、患者のサージカルマスク着用や医療従事者のN95マスク着用、個室の陰圧管理などの対策がとられる。
飛沫感染と空気感染のあいだ
SARS-CoVは飛沫感染だけでなく空気感染もありうることが疫学研究から示唆されており[3]、飛沫感染だけか空気感染もするのかはグレーゾーンという扱いである。他の病原体についても空気感染するのかよく分からないものがたくさんあり(表1)[4、5]、「空気感染と飛沫感染のあいだ」は意外ときれいには分けられないものである[6]。
表1 飛沫感染する病原体、空気感染する病原体| 飛沫感染する病原体 | 空気感染しうる病原体 |
|
Adenoviruses Bordetella pertussis Coronaviruses Ebola virus Enteroviruses Influenza viruses Mumps virus Mycoplasma pneumoniae Neisseria meningitidis Norovirus Respiratory syncytial virus Rhinoviruses Rubeola virus Staphylococcus aureus Streptococcus pyogenes Varicella-zoster virus |
Adenoviruses Aspergillus sp. Coronaviruses Ebola virus Enteroviruses Influenza viruses Mycobacterium tuberculosis Norovirus Respiratory syncytial virus Rhinoviruses Rubeola virus Varicella-zoster virus |
(文献4、5より引用改変)
しかし、“一応は”ルールを決めておかねばならない。飛沫感染か空気感染かの境界線は病原体を含む粒子の大きさで定められており、WHOは粒子径5μmをカットオフにしている[7]。この定義は粒子が到達可能な距離が1m前後か、それ以上になるかを重視して定められているが、粒子が下気道に到達可能なサイズ(<10μm)かどうかを重視して、粒子径10μmをカットオフとする専門家もいる(表2)[4、8]。5μm以下の微細な粒子をエアロゾルと同義に用いられていることが多いが、我われが調べ得た範囲ではエアロゾルという用語について広く受け入れられた定義はないようであり、学問分野や文献によって異なる定義が用いられているのが実情である。例えば、CDCでは「空気中の小粒子や飛沫が浮遊している状態(a suspension of tiny particles or droplets in the air, such as dusts, mists, or fumes)」 [9]、WHOでは「大気中に浮遊した粒子の形成する系(a system of particles suspended in a gaseous medium)」[10]、日本エアロゾル学会では「気体中に浮遊する微小な液体または固体の粒子と周囲の気体の混合体」と定義している [11]。この統一されていない定義が語用論的な混乱を招いているのも現状である。
表2 粒子径と体内の到達可能部位| 部位ごとに定着するエアロゾルの量(%) | ||||
| 解剖学的部位 | 0.1μm | 1μm | 10μm | 100μm |
| 咽喉頭 | 2.1 | 29 | 81 | 50 |
| 気管・気管支 | 2.7 | 2.7 | 1.5 | <0.1 |
| 肺胞 | 14 | 12 | 1.9 | <0.1 |
「粒子径」と簡単に書いたが、実はこれも難しい概念である。温度や湿度などの条件にもよるが、蒸発によって粒子径は絶えず変わってしまう [12]。粒子径を統一された方法で測定すること自体が困難であることから、粒子径によって飛沫感染と空気感染を厳密に線引きするのも実はあまり現実的でないように見える。
エアロゾルを介した感染に影響する因子
エアロゾルを介した感染には大きく①病原体因子、②宿主因子、③環境因子の3つが関与する[5、8、13]。
1.病原体の影響
一般にエンベロープのあるウイルス(インフルエンザウイルス、コロナウイルスなど)は低い湿度(20~30%)で、エンベロープのないウイルス(アデノウイルス、ライノウイルスなど)は高い湿度(70~90%)で長く感染性を維持する[14]。また、エアロゾルに含まれる病原体量が感染成立に必要な量でなければ感染は成立しない。一定サイズのエアロゾルに含まれる病原体量は病原体サイズで規定されており、粒子径によって感染成立に必要な病原体数を運搬可能かどうかも変わってきてしまう(表3)[15、16]。
表3 感染成立に必要な病原体数| 病原体 | HID50 |
| Adenovirus | 0.5 TCID50 | Coxsackievirus | 6 TCID50 | Influenza virus | 0.6~3 TCID50 | Mycobacterium tuberculosis | <10 bacilli | Neisseria meningitidis | 不明 | Norovirus | 18 virions | Respiratory syncytial virus | 30~40 TCID50 | Rhinovirus | 0.032 TCID50 | Rubeola virus | 不明 | Streptococcus pyogenes | 不明 | Varicella-zoster virus | 不明 |
*2 TCID50:50%組織培養感染量(ウイルスを定量する単位の一つ)
(文献15、16より引用改変)
2.宿主の影響
宿主の行動内容・回数、感染・定着部位、免疫状態も感染成立に影響を与える。咳やくしゃみなどの回数が多いと感染しやすい。咳では1回700個程度、くしゃみでは1回4万個程度のエアロゾルを発生する[4]。これらの行為でのエアロゾル発生部位と病原体の感染・定着部位が一致しない場合は、エアロゾルが体液で希釈されて感染性が低下するかもしれない。炎症に伴い体液の粘稠性が上昇すると、発生するエアロゾルの粒子径が大きくなる。また、既感染もしくはワクチンで抗体を獲得しているかも感染性に影響する。
3.環境の影響
温度、湿度、紫外線、定着物質も感染の成立には重要である。例えば、気温30℃以上でインフルエンザの感染が抑制されることが知られている。DNAウイルスは一般にRNAウイルスより高温に安定である。前述のように、エンベロープのあるウイルスは湿度が高いと感染しにくい。また、紫外線照射でウイルスの感染性が低下する[17]。病原体が血液や糞便、喀痰に含まれると、温度や湿度、紫外線による病原体へのストレスが軽減されて感染性が維持されやすい。
空気感染の細分類
空気感染を起こす可能性のある病原体を細分類する試みもなされている。具体的には、絶対的空気感染(obligate)、比較的空気感染(preferential)、条件付き空気感染(opportunistic)の3つに分類する[18]。
絶対的空気感染は、結核菌のように空気感染のみを感染経路とする場合を指す。比較的空気感染は、空気感染以外でも感染するが、主に空気感染を感染経路とする場合を指し、水痘・帯状疱疹ウイルスと麻疹ウイルスが該当する。条件付き空気感染は、基本的には空気感染以外の感染経路をとるが、気管挿管などのエアロゾル発生手技を行った場合などに限って空気感染する場合を指す。インフルエンザウイルスやSARS-CoVなどがこれに該当する[19]。インフルエンザウイルスやSARS-CoVを念頭に置く場合は基本的にはN95マスク着用などの空気感染対策を要さないが、エアロゾル発生手技を行う場合に限っては必要だとされている。
エアロゾル発生手技とは何か
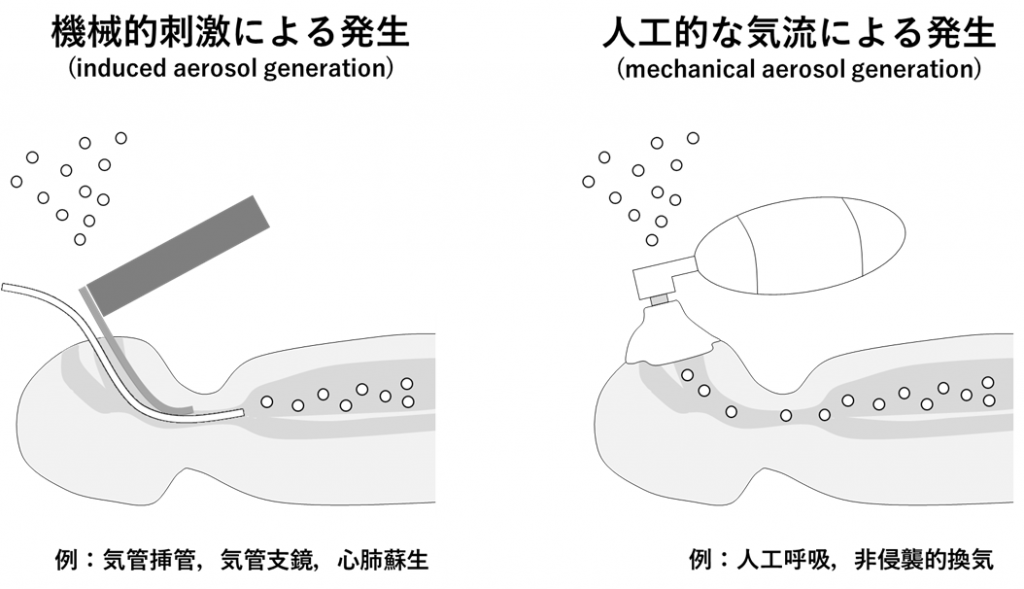
エアロゾル発生手技とは、患者が常時行っている呼吸や咳、くしゃみなどで発生する量を超える量のエアロゾルを発生する可能性のある医療行為を指す[20]。しかし、エアロゾル発生手技と考えられている医療行為の中でも実際にエアロゾルが発生していることを確認できているものは決して多くない[21]。現時点で確定しているものとしては、気管支鏡検査、心肺蘇生、非侵襲的換気、気管挿管 、用手的人工呼吸などが挙げられるが、ネブライザーや喀痰吸引についてはいまだ議論がある[21]。
エアロゾル発生手技は、エアロゾルの発生が機械刺激によるか(induced aerosol generation)、気流の発生によるか(mechanical aerosol generation)で大きく分類することもでき[21]、前者には気管支鏡検査や気管挿管などが、後者には非侵襲的換気や用手的人工呼吸などが該当する(表4、図1)[21]。エアロゾル発生手技という条件付きで空気感染を起こす病原体としては、インフルエンザウイルスやSARS-CoVを筆頭に[22]、動物実験レベルではエボラ出血熱ウイルスなども挙げられる[22]。
表4 エアロゾル発生手技の一覧| エアロゾル発生手技 | 発生機序 |
| 気管支鏡検査 | 呼吸器系からの咳やくしゃみを誘発 | 心肺蘇生 | 呼吸器系からの咳やくしゃみを誘発 | 非侵襲的換気 | 人工的な気流で呼吸器系由来のエアロゾルを拡散 | 気管挿管 | 呼吸器系からの咳やくしゃみを誘発 | 用手的人工呼吸 | 人工的な気流で呼吸器系由来のエアロゾルを拡散 | 手術 | 骨など硬い組織の切断時や液体吸引時にエアロゾルを発生 | 喀痰誘発 | 呼吸器系からの咳やくしゃみを誘発 | ネブライザー | 人工的な気流で呼吸器系由来のエアロゾルを拡散 | 喀痰吸引 | 人工的な気流で呼吸器系由来のエアロゾルを拡散 | レーザープルーム | 人工的な気流で呼吸器系由来のエアロゾルを拡散 |
(文献21より引用改変)
**
それではなぜ、インフルエンザウイルスやSARS-CoVは普段空気感染を起こさないのだろうか。残念ながら、メカニズムはいまだよく分かっていない。機械によって発生するエアロゾルはヒトから出るエアロゾルよりも粒子径が小さくなりやすいなど、実験系の確立が難しいことも検証を困難にしている要因である[23]。
エアロゾルをどう除去するか
エアロゾル発生手技後の部屋で空気感染を防ぐには、エアロゾルを除去しなければならない。空気感染は院内感染の10~20%とも20~24%ともいわれているが、いずれにしても看過できない数値である[24、25]。具体的にどのようなプロトコルでエアロゾルを除去するかを知るためには、換気についての知識が重要である。
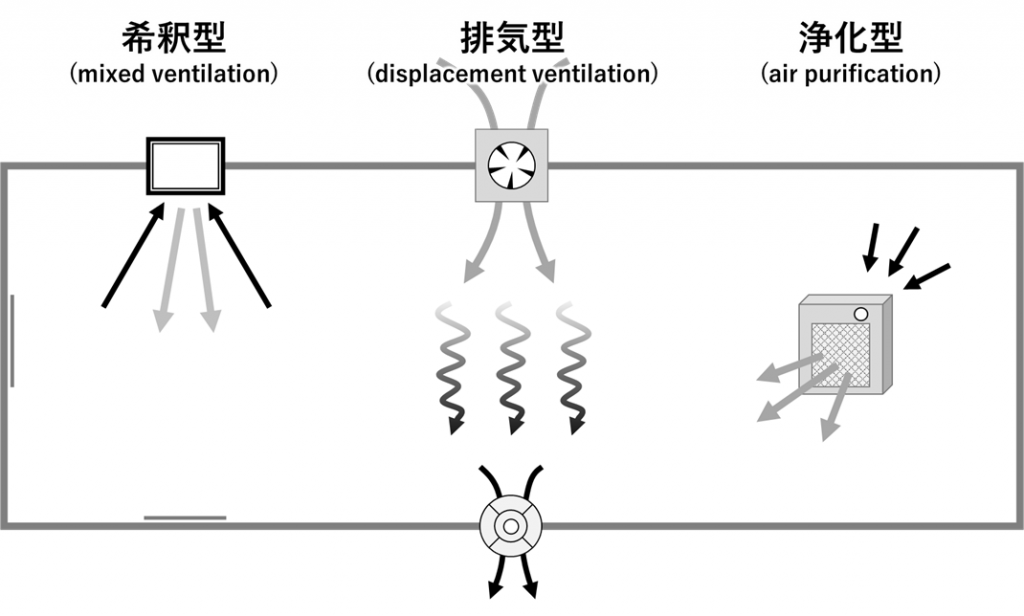
換気方法は、空気の汚染度の減らし方によって、希釈型(mixed ventilation)、排気型(displacement ventilation)、浄化型(air purification)の3つに大別される(図2)[5]。希釈型は汚染された空気を汚染されていない空気と混和することで汚染度を減らす方法、排気型は汚染された空気を排出しつつも別の場所から汚染されていない空気を導入する方法、浄化型はフィルターや活性酸素、紫外線などで空気中の汚染物質を除去・分解する方法である[3]。これらの中で排気型では汚染した空気が一定期間残留し、感染拡大に寄与する可能性もあるため、医療機関で使用する際には天井から床に向けて空気が流れる仕組みにすることが推奨されている。
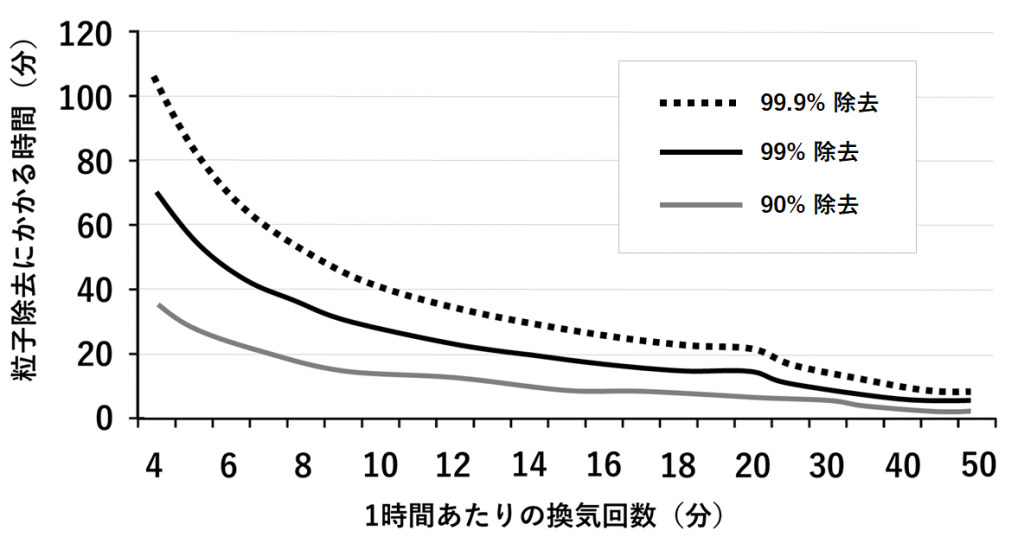
では、実際に換気することで粒子数を減らせるかというと、案外その効果はいま一つである(図3)[26、27]。例えば、1時間に4回換気する場合、粒子数を90%減らすのに40分、99%減らすのに70分かかる計算になり、効率が悪い。ただ、換気回数を増やすことで除去効率をある程度まで上げることは可能で、1時間に12回換気すれば、粒子数を90%減らすのに10分、99%減らすのにも20分強程度で済むようである。このことを踏まえ、病院の隔離病床では1時間に12回の換気が推奨されている[26]。換気回数が1時間に20回を超えるところから粒子除去効率が低下するため、2~3分に1回も換気するメリットは少ないと考えられる。換気回数が増えすぎることで患者が不快感を覚えることも考えると、1時間に20回以下というのは現実的なラインかと思われる。
実際的な換気の例としては、飛行機がよく引き合いに出される[4]。結核などで感染性のある乗客から2列以内の席に8時間いると空気・飛沫感染を起こす可能性があり[28、29]、機内においても空調設備が非常に重要である。1時間に1回換気するだけでも空気感染する病原体を63%除去できるとされているが[30]、現在の航空会社の多くが1時間に15~20回の換気を採用しており[31]、空気感染のリスクは最低限に抑えられていると考えられる。逆に、機内で換気を行わなかったことでインフルエンザのアウトブレイクが発生した事例もこれまでに存在する[32]。
マスクの話
施設レベルだけではなく、個人レベルでの防護も空気感染対策に重要である。サージカルマスクのように口や鼻だけを覆うマスクが医療現場に登場したのは1910年代のことであり[33]、結核のアウトブレイクを契機にN95マスクなどの必要性が唱えられたのが1990年代であったことを考えると[34]、防護用マスクの歴史は決して長いものではない。
マスク学の進歩はまずSARS-CoVの感染拡大とともに訪れた[5]。SARS-CoVのアウトブレイク中に、一般人および医療従事者におけるサージカルマスクによる感染予防効果が報告された[35]。N95マスクとアイゴーグルを着用することによるSARS-CoVへの感染予防効果が報告され、目の防護の重要性も認識されるようになった[36]。麻疹ウイルスや水痘・帯状疱疹ウイルスのように、空気感染するウイルスがサージカルマスクでは十分には予防できないと考えられたのもこの時期である[5]。
2020年1月以降のSARS-CoV-2の流行状況を受け、マスクによる感染予防効果の検証はさらに進んだ。サージカルマスクによる呼吸器ウイルスの排出抑制効果を示す研究だけでなく [37]、N95マスクのほうがサージカルマスクに比べSARS-CoV-2感染の伝播減少により効果があることを示唆するメタ分析も発表された [38]。ただし、実際にN95マスクとサージカルマスクによるSARS-CoV-2感染抑制効果を直接比較した研究は今のところなく [39]、引き続き検証を続けていく必要があるだろう。
最後に
日常的によく使う言葉であるにもかかわらず、意外とよく知られていないエアロゾルについて、現時点で分かっている事柄を整理した。飛沫感染と空気感染を厳密に分けることは難しく、いわゆるエアロゾル発生手技を行う場合には空気感染対策の必要性を吟味する必要がある。また、エアロゾルを介した感染拡大を防ぐには、換気などの施設設備やマスクなどの個人防護の知識も不可欠である。本稿に記したエアロゾルの知識は、新型コロナウイルスへの感染対策のみならず、来るべき新たな感染症への対策にもぜひ役立てていただきたい。
【References】
1)Morawska L, Milton DK: It is Time to Address Airborne Transmission of COVID-19. Clin Infect Dis. 2020 Jul 6; ciaa939. Online ahead of print.
2)CDC: 2007 Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings.
https://www.cdc.gov/infectioncontrol/pdf/guidelines/isolation-guidelines-H.pdf
3)Yu IT, Li Y, Wong TW, et al: Evidence of airborne transmission of the severe acute respiratory syndrome virus. N Engl J Med. 2004 Apr 22; 350(17): 1731-9.
4)Fernstrom A, Goldblatt M: Aerobiology and its role in the transmission of infectious diseases. J Pathog. 2013; 2013: 493960.
5)Bing-Yuan, Zhang YH, Leung NHL, et al: Role of viral bioaerosols in nosocomial infections and measures for prevention and control. J Aerosol Sci. 2018 Mar; 117: 200-11.
6)Cole EC, Cook CE: Characterization of infectious aerosols in health care facilities: an aid to effective engineering controls and preventive strategies. Am J Infect Control. 1998 Aug; 26(4): 453-64.
7)WHO: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
8)Hinds WC: Aerosol Technology―Properties, Behavior, and Measurement of Airborne Particles, 2nd ed., JohnWiley & Sons, 1999.
9) CDC: The National Institute for Occupational Safety and Health (NIOSH). https://www.cdc.gov/niosh/topics/aerosols/default.html
10) WHO: Hazard Prevention and Control in the Work Environment: Airborne Dust. https://www.who.int/occupational_health/publications/en/oehairbornedust3.pdf
11) 日本エアロゾル学会: エアロゾルとは.
https://www.jaast.jp/new/about_aerosol.html
12)Wells WF: On Air-borne Infection: Study II. Droplets and Droplet Nuclei. American Journal of Epidemiology. 1934 Nov; 20(3): 611-8.
13)Gralton J, Tovey E, McLaws ML, et al: The role of particle size in aerosolised pathogen transmission: a review. J Infect. 2011 Jan; 62(1): 1-13.
14)Tang JW: The effect of environmental parameters on the survival of airborne infectious agents. J R Soc Interface. 2009 Dec 6; 6 Suppl 6(Suppl 6): S737-46.
15)Yezli S, Otter JA: Minimum Infective Dose of the Major Human Respiratory and Enteric Viruses Transmitted Through Food and the Environment. Food Environ. 2011; 3: 1-30.
16)Government of Canada: Pathogen Safety Data Sheets.
https://www.canada.ca/en/public-health/services/laboratory-biosafety-biosecurity/pathogen-safety-data-sheets-risk-assessment.html
17)McDevitt JJ, Lai KM, Rudnick SN, et al: Characterization of UVC light sensitivity of vaccinia virus. Appl Environ Microbiol. 2007 Sep; 73(18): 5760-6.
18)Roy CJ, Milton DK: Airborne transmission of communicable infection–the elusive pathway. N Engl J Med. 2004 Apr 22; 350(17): 1710-2.
19)Seto WH: Airborne transmission and precautions: facts and myths. J Hosp Infect. 2015 Apr; 89(4): 225-8.
20)Davies A, Thomson G, Walker J, et al: A review of the risks and disease transmission associated with aerosol generating medical procedures. J Infect Prev. 2009; 10(4): 122-6.
21)Judson SD, Munster VJ: Nosocomial Transmission of Emerging Viruses via Aerosol-Generating Medical Procedures. Viruses. 2019 Oct 12; 11(10): 940.
22)Nakayama E, Saijo M: Animal models for Ebola and Marburg virus infections. Front Microbiol. 2013 Sep 5; 4: 267.
23)Tang JW, Wilson P, Shetty N, et al: Aerosol-Transmitted Infections-a New Consideration for Public Health and Infection Control Teams. Curr Treat Options Infect Dis. 2015; 7(3): 176-201.
24)Brachman PS, Eickhoff TC: Proceedings of the International Conference on Hospital-Acquired Infections, Hospital-acquired infection—airborne or not?, American Hospital Association, 1971.
25)Kundsin RB: Documentation of airborne infection during surgery. Ann N Y Acad Sci. 1980; 353: 255-61.
26)ASHRAE/ASHE Standard 170-2008 Ventilation of Health Care Facilities Ventilation of Health Care Facilities, the American Society of Heating, Refrigerating and Air-Conditioning Engineers, 2008.
27)National Institutes of Health Biosafety Level 3-Laboratory Certification Requirements. https://www.orf.od.nih.gov/TechnicalResources/Bioenvironmental/Documents/
BSL3CertificationGuidelinesFINAL_508.pdf
28)Kenyon TA, Valway SE, Ihle WW, et al: Transmission of multidrug-resistant Mycobacterium tuberculosis during a long airplane flight. N Engl J Med. 1996 Apr 11; 334(15): 933-8.
29)Olsen SJ, Chang HL, Cheung TY, et al: Transmission of the severe acute respiratory syndrome on aircraft. N Engl J Med. 2003 Dec 18; 349(25): 2416-22.
30)Nardell EA, Keegan J, Cheney SA, et al: Airborne infection. Theoretical limits of protection achievable by building ventilation. Am Rev Respir Dis. 1991 Aug; 144(2):302-6.
31)Mangili A, Gendreau MA: Transmission of infectious diseases during commercial air travel. Lancet. 2005 Mar 12-18; 365(9463): 989-96.
32)Moser MR, Bender TR, Margolis HS, et al: An outbreak of influenza aboard a commercial airliner. Am J Epidemiol. 1979 Jul; 110(1): 1-6.
33)Strasser BJ, Schlich T: A history of the medical mask and the rise of throwaway culture. Lancet. 2020 Jul; 396(10243): 19-20.
34)CDC: 100 Years of Respiratory Protection History.
https://www.cdc.gov/niosh/npptl/Respiratory-Protection-history.html
35)Seto WH, Tsang D, Yung RW, et al; Effectiveness of precautions against droplets and contact in prevention of nosocomial transmission of severe acute respiratory syndrome (SARS). Lancet. 2003 May; 361(9368): 1519-20.
36)Bischoff WE, Reid T, Russell GB, et al: Transocular entry of seasonal influenza-attenuated virus aerosols and the efficacy of n95 respirators, surgical masks, and eye protection in humans. J Infect Dis. 2011 Jul; 204(2): 193-9.
37) Leung NHL, Chu DKW, Shiu EYC, Chan KH, McDevitt JJ, Hau BJP, Yen HL, Li Y, Ip DKM, Peiris JSM, Seto WH, Leung GM, Milton DK, Cowling BJ; Respiratory virus shedding in exhaled breath and efficacy of face masks. Nat Med. 2020 May; 26(5): 676-80.
38) Chu DK, Akl EA, Duda S, Solo K, Yaacoub S, Schünemann HJ; COVID-19 Systematic Urgent Review Group Effort (SURGE) Study Authors: Physical distancing, face masks, and eye protection to prevent person-to-person transmission of SARS-CoV-2 and COVID-19: a systematic review and meta-analysis. Lancet. 2020 Jun;395(10242): 1973-87.
39) Klompas M, Baker MA, Rhee C: Airborne Transmission of SARS-CoV-2: Theoretical Considerations and Available Evidence. JAMA. 2020 Aug;324(5): 441-2.